Class 10 Science Chapter 2 अम्ल, क्षार और लवण
Class 10 Science Chapter 2 अम्ल, क्षार और लवण
एनसीईआरटी समाधान कक्षा 10 विज्ञान अध्याय 2 एनसीईआरटी अंत अभ्यास
प्रश्न 1.
एक विलयन लाल लिटमस को नीला कर देता है। इसका पीएच
(ए) 2
(बी) 4
(सी) 7
(डी) 10
होने की संभावना है। उत्तर:
समाधान बुनियादी है। इसका पीएच 10 होने की संभावना है।
इसलिए, (डी) सही उत्तर है।
प्रश्न 2.
चूने के पानी को दूधिया करने वाली गैस बनाने के लिए एक घोल कुचले हुए अंडे के छिलकों के साथ प्रतिक्रिया करता है। विलयन में
(a) NaCl
(b) HCl
(c) LiCl
(d) KCl होता है।
उत्तर:
कुचले हुए अंडे के छिलकों में कैल्शियम कार्बोनेट की परत होती है जो तनु HCl से क्रिया करके CO , ( g) बनाती है। गैस चूने के पानी को दूधिया कर देती है।
इसलिए (बी) सही विकल्प है।
प्रश्न 3.
NaOH के विलयन का 10 mL HCl के दिए गए विलयन के 8 mL द्वारा पूर्णतः उदासीन पाया जाता है। यदि हम NaOH के समान विलयन का 20 mL लें, तो उदासीनीकरण के लिए आवश्यक HCl विलयन (पहले जैसा ही घोल) का आयतन होगा
(a) 4 mL
(b) 8 mL
(c) 12 mL
(d) 16 mL।
उत्तर:
10 एमएल NaOH के लिए HCl = 8 mL और NaOH के 20 mL के लिए HCl=16 mL की आवश्यकता होगी।
इसलिए, (डी) सही उत्तर है।
प्रश्न 4.
अपच के इलाज के लिए निम्न में से किस प्रकार की दवाओं का उपयोग किया जाता है?
(ए) एंटीबायोटिक
(बी) एनाल्जेसिक
(सी) एंटासिड
(डी) एंटीसेप्टिक।
उत्तर:
अपच के इलाज के लिए एंटासिड का उपयोग किया जाता है।
सही उत्तर है (सी)।
प्रश्न 5.
अभिक्रियाओं के लिए समीकरण और संतुलित समीकरण लिखिए जब :
(a) तनु सल्फ्यूरिक अम्ल जिंक के दानों के साथ अभिक्रिया करता है।
(b) तनु हाइड्रोक्लोरिक अम्ल मैग्नीशियम रिबन से अभिक्रिया करता है।
(सी) पतला सल्फ्यूरिक एसिड एल्यूमीनियम पाउडर के साथ प्रतिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल लोहे के भराव से अभिक्रिया करता है।
(d) तनु हाइड्रोक्लोरिक अम्ल लोहे के भराव से अभिक्रिया करता है।
जवाब:
प्रश्न 6.
अल्कोहल और ग्लूकोज जैसे यौगिकों में भी हाइड्रोजन होता है लेकिन एसिड के रूप में नहीं होता है। इसे सिद्ध करने के लिए एक क्रियाकलाप का वर्णन कीजिए।
एथिल अल्कोहल का रासायनिक सूत्र C 2 H 5 OH है जो एक अल्कोहल है और ग्लूकोज का C 6 H 12 O 6 है। दोनों कार्बनिक यौगिक हैं और इनमें हाइड्रोजन परमाणु होते हैं। हालांकि, वे एसिड के रूप में व्यवहार नहीं करते हैं। (सीबीएसई 2011, 2013)
उत्तर:
यह निम्नलिखित गतिविधि द्वारा दिखाया जा सकता है:
एक कांच के बीकर में, ग्लूकोज का एक पतला घोल लें (सी 6 एच 12 ओ 6) एक रबर कॉर्क में लोहे की दो छोटी कीलें लगाएँ और कॉर्क को बीकर में रखें जैसा कि चित्र में दिखाया गया है। एक बल्ब के माध्यम से कीलों को 6 वोल्ट की बैटरी के टर्मिनलों से जोड़ें। करंट चालू करें। बल्ब नहीं जलेगा। इससे पता चलता है कि विद्युत प्रवाह ग्लूकोज के घोल से नहीं गुजरा है। चूँकि करंट आयनों की गति से चलता है, इससे पता चलता है कि घोल में ग्लूकोज ने कोई H + आयन नहीं दिया है।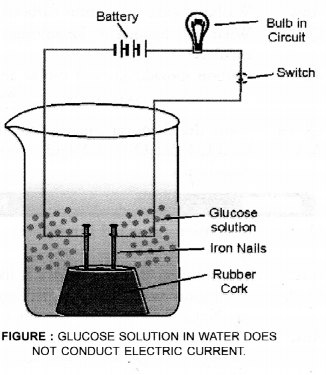
अब यही प्रयोग एथिल अल्कोहल (C 2 H 5 OH) के साथ दोहराएं। इस स्थिति में भी बल्ब नहीं जलेगा। इससे पता चलता है कि दोनों एसिड के रूप में व्यवहार नहीं करते हैं, हालांकि उनके अणुओं में हाइड्रोजन परमाणु होते हैं।
प्रश्न 7.
आसुत जल विद्युत का चालन क्यों नहीं करता जबकि वर्षा जल करता है ?
उत्तर:
शुद्ध पानी (या आसुत जल) एक बहुत ही कमजोर इलेक्ट्रोलाइट है और आयनों में अलग नहीं होता है। इसलिए, यह बिजली का संचालन नहीं करता है। हालांकि, बारिश के पानी में कार्बोनिक एसिड (एच 2 सीओ 3 ) और सल्फ्यूरस एसिड (एच 2 एसओ 3 ) जैसे कुछ भंग एसिड होते हैं। दरअसल हवा में CO2और SO2 दोनों गैसों के अंश होते हैं जो बारिश के पानी में घुलकर संबंधित एसिड बनाते हैं। नतीजतन, पानी अम्लीकृत हो जाता है और आसानी से आयनित हो जाता है। इसलिए, वर्षा जल विद्युत का संचालन करता है।
प्रश्न 8.
जल की अनुपस्थिति में अम्ल कोई अम्लीय व्यवहार क्यों नहीं दिखाता है?
उत्तर:
अम्ल केवल जलीय विलयन में अर्थात जल की उपस्थिति में आयनित होता है। दूसरे शब्दों में, एक अम्ल H+ आयन छोड़ता है या केवल पानी की उपस्थिति में अम्लीय व्यवहार दिखाता है।
प्रश्न 9.
पांच विलयनों A, B, C, D और E का जब सार्वत्रिक संकेतक से परीक्षण किया जाए तो pH क्रमशः 4, 2, 12, 7 और 9 प्रदर्शित होता है। कौन सा घोल है:
(ए) तटस्थ
(बी) दृढ़ता से क्षारीय
(सी) दृढ़ता से अम्लीय
(डी) कमजोर क्षारीय
(ई) कमजोर अम्लीय (एफ) एच + आयन एकाग्रता
के बढ़ते क्रम में पीएच को व्यवस्थित करें
उत्तर: (ए) तटस्थ: डी पीएच = 7 (बी) मजबूत क्षारीय: सी पीएच = 12 (सी) मजबूत अम्लीय: पीएच = 2 के साथ बी (डी) कमजोर क्षारीय: ई पीएच = 9 के साथ (ई) कमजोर अम्लीय : A pH = 4 के साथ (f) H+ आयनों की सांद्रता का बढ़ता क्रम :C<E<D<A<B
प्रश्न 10.
परखनली A और B में समान लंबाई के मैग्नीशियम रिबन लिए जाते हैं। परखनली A में हाइड्रोक्लोरिक एसिड (HCl) मिलाया जाता है जबकि परखनली B में एसिटिक एसिड (CH 3 COOH) मिलाया जाता है। किस स्थिति में, फ़िज़िंग अधिक होती है जोर से और क्यों?
उत्तर:
एसिड पर धातु की क्रिया से हाइड्रोजन गैस के विकास के कारण प्रतिक्रिया में फ़िज़िंग होता है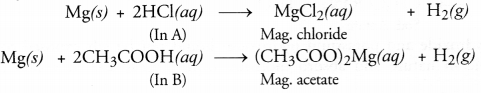
क्योंकि हाइड्रोक्लोरिक एसिड एसिटिक एसिड की तुलना में अधिक मजबूत एसिड होता है, ट्यूब बी की तुलना में ट्यूब ए में अधिक आसानी से फ़िज़िंग होता है। वास्तव में हाइड्रोजन गैस विकसित होगी परखनली A में अधिक तेज गति से।
प्रश्न 11.
ताजे दूध का pH 6 होता है। आपको क्या लगता है कि जैसे ही यह दही में बदलेगा, pH कैसे बदलेगा? अपना जवाब समझाएं। (सीबीएसई 2011)
उत्तर:
जब दूध दही में बदल जाता है, तो पीएच कम हो जाता है। दरअसल, दूध में मौजूद लैक्टोज (कार्बोहाइड्रेट) लैक्टिक एसिड में बदल जाता है। जैसे-जैसे अधिक अम्ल बनता है, माध्यम का pH कम होता जाता है।
प्रश्न 12.
एक दूधवाला ताजे दूध में बहुत कम मात्रा में बेकिंग सोडा मिलाता है।
(ए) वह ताजे दूध के पीएच को 6 से थोड़ा क्षारीय में क्यों स्थानांतरित करता है?
(ख) यह दूध दही के रूप में जमने में अधिक समय क्यों लेता है ? (सीबीएसई 2011)
उत्तर:
(ए) हम जानते हैं कि लैक्टिक एसिड की उपस्थिति के कारण दूध थोड़ा अम्लीय होता है और इसका पीएच 6 होता है।
खड़े होने पर, इसका पीएच धीरे-धीरे कम हो जाता है और अधिक एसिड निकलने के कारण यह खट्टा हो जाता है। बेकिंग सोडा या सोडियम हाइड्रोजन कार्बोनेट (NaHCO 3 ) मिलाने का उद्देश्य मध्यम थोड़ा क्षारीय बनाना है। जारी किया गया बेस दूध में मौजूद लैक्टिक एसिड के प्रभाव को बेअसर कर देगा। इससे दूध खट्टा होने से बच जाएगा।
(बी) जब दूध दही के रूप में सेट हो जाता है, तो यह अधिक अम्लीय हो जाता है और पीएच कम हो जाता है। क्षारीय माध्यम में, अम्लीय माध्यम को वापस प्राप्त करने में अधिक समय लगता है ताकि दूध दही के रूप में सेट हो सके।
प्रश्न 13.
प्लास्टर ऑफ पेरिस को नमी रोधी पात्र में क्यों रखना चाहिए ?
उत्तर:
नमी की उपस्थिति में, प्लास्टर ऑफ पेरिस हाइड्रेटेड हो जाता है और जिप्सम में बदल जाता है जो एक कठोर द्रव्यमान होता है।![]()
इसका उपयोग अब सांचे और मूर्तियाँ बनाने के लिए नहीं किया जा सकता है। इसलिए प्लास्टर ऑफ पेरिस को नमी प्रूफ कंटेनर या बैग में रखा जाता है।
प्रश्न 14.
उदासीनीकरण अभिक्रिया क्या है ? दो उदाहरण दीजिए।
उत्तर:
उदासीनीकरण अभिक्रिया अम्ल और क्षार के जलीय विलयन में घुलने से लवण और जल बनाने की अभिक्रिया है।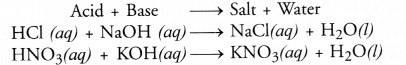
प्रश्न 15.
NaCl और KNO 3 दोनों ही उदासीन प्रकृति के हैं। वे न तो नीले लिटमस को लाल और न ही लाल लिटमस को नीले रंग में बदलते हैं। इसलिए इस अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं।
धोने का सोडा और बेकिंग सोडा के दो महत्वपूर्ण उपयोग बताइए। (सीबीएसई 2011)
उत्तर:
वाशिंग सोडा के उपयोग:
- कास्टिक सोडा (NaOH) और बोरेक्स (Na 2 B 4 O 7 ) आदि जैसे कांच, साबुन, कागज और रसायनों के निर्माण में ।
- घरेलू उद्देश्यों के लिए सफाई एजेंट के रूप में।
बेकिंग सोडा के उपयोग:
- बेकिंग पाउडर में केक बनाने के लिए इस्तेमाल किया जाता है।
- एंटासिड में पेट में अम्लता को कम करने के लिए।