Class 10 Science Chapter 3 धातु और अधातु
Class 10 Science Chapter 3 धातु और अधातु
प्रश्न 1.
निम्नलिखित में से कौन विस्थापन अभिक्रिया देगा?
(ए) NaCl समाधान और तांबा धातु
(बी) एमजीसीएल 2 समाधान और एल्यूमीनियम धातु (
सी) FeSO4समाधान और चांदी धातु (डी) AgNO3 समाधान और तांबा धातु। उत्तर: (डी)। केवल AgNO3 विलयन कॉपर (Cu) के साथ विस्थापन अभिक्रिया देगा क्योंकि क्रियाकलाप श्रेणी में कॉपर को चांदी के ऊपर रखा जाता है।
प्रश्न 2.
लोहे के फ्राइंग पैन को जंग लगने से बचाने के लिए निम्नलिखित में से कौन सी विधि उपयुक्त है?
(a) ग्रीस लगाना
(b) पेंट लगाना
(c) जिंक का लेप लगाना
(d) उपरोक्त सभी।
उत्तर:
सैद्धांतिक रूप से तीनों विधियाँ एक लोहे के फ्राइंग पैन को जंग लगने से बचाने में सहायक होती हैं। हालांकि, ग्रीस और पेंट दोनों के घटक ज्यादातर कार्बनिक यौगिक होते हैं। वे गर्मी का सामना नहीं कर सकते और न ही टिकते हैं। इसलिए, जस्ता (गैल्वेनाइजेशन) का लेप लगाना सबसे अच्छा तरीका है। विकल्प (सी) सही है।
प्रश्न 3.
एक तत्व ऑक्सीजन के साथ अभिक्रिया करके उच्च गलनांक वाला यौगिक देता है। यह यौगिक पानी में घुलनशील भी है। तत्व होने की संभावना है:
(ए) कैल्शियम
(बी) कार्बन
(सी) सिलिकॉन
(डी) लौह
उत्तर:
(ए)। कैल्शियम (Ca) ऑक्सीजन के साथ मिलकर बहुत उच्च गलनांक के साथ कैल्शियम ऑक्साइड (CaO) बनाता है। CaO कैल्शियम हाइड्रॉक्साइड बनाने के लिए पानी में घुल जाता है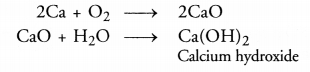
प्रश्न 4.
खाने के डिब्बे को टिन से लेप किया जाता है न कि जिंक से, क्योंकि
(a) जिंक टिन से महंगा होता है
(b) जिंक का गलनांक टिन से
अधिक होता है (c) जिंक टिन से अधिक क्रियाशील होता है
(d) जिंक टिन से कम क्रियाशील होता है .
उत्तर:
(सी)। टिन की तुलना में जिंक अधिक क्रियाशील होता है और भोजन में उपस्थित कार्बनिक अम्लों के साथ क्रिया करके जहरीले यौगिक बनाता है। चूंकि टिन को गतिविधि श्रृंखला में जस्ता के नीचे रखा गया है, यह कम प्रतिक्रियाशील है और कार्बनिक अम्लों के साथ प्रतिक्रिया नहीं करता है। इसलिए, (सी) सही विकल्प है।
प्रश्न 5.
आपको एक हथौड़ा, एक बैटरी, एक बल्ब, तार और एक स्विच दिया जाता है :
(क) प्रवाह क्या आप इनका उपयोग धातुओं और अधातुओं के नमूनों में अंतर करने के लिए कर सकते हैं?
(बी) धातुओं और गैर धातुओं के बीच अंतर करने के लिए इन परीक्षणों की उपयोगिता का आकलन करें।
उत्तर:
(ए) हथौड़े की मदद से धातु और अधातु (ठोस) दोनों को प्लेट या छड़ के रूप में परिवर्तित करें। धातु आसानी से इनका निर्माण करेगी क्योंकि ये निंदनीय हैं। भंगुर होने के कारण अधातु हथौड़े से मारने पर टूट जाएगी। वे कठिनाई से प्लेटें बनाएंगे। अब इन प्लेटों का इलेक्ट्रोड के रूप में उपयोग करके दोनों मामलों में एक सेल का निर्माण करें और करंट को चालू करें। यदि बल्ब जलता है, तो इसका अर्थ है कि इलेक्ट्रोड धातुओं के हैं। मामले में, यह चमक नहीं करता है, इसका मतलब है कि इलेक्ट्रोड अधातु के हैं।
(बी) इन परीक्षणों से, हम यह निष्कर्ष निकाल सकते हैं कि
- धातु निंदनीय हैं जबकि अधातु नहीं हैं।
- धातुएँ विद्युत की सुचालक होती हैं जबकि गैर-भोजन नहीं (ग्रेफाइट एक अपवाद है)।
प्रश्न 6.
उभयधर्मी ऑक्साइड क्या हैं? दो उभयधर्मी ऑक्साइड के उदाहरण दीजिए।
उत्तर:
ये वे ऑक्साइड हैं जो अम्ल और क्षार दोनों के रूप में कार्य कर सकते हैं। उदाहरण के लिए, एल्युमिनियम ऑक्साइड (Al 2 O 3 ) और जिंक ऑक्साइड (ZnO)। दो आक्साइडों के उभयधर्मी चरित्र को निम्नलिखित प्रतिक्रियाओं द्वारा दिखाया गया है।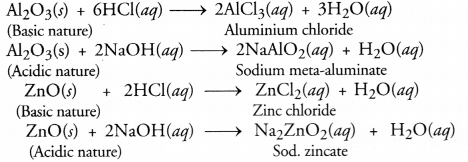
प्रश्न 7.
दो धातुओं के नाम लिखिए जो तनु अम्लों से हाइड्रोजन को विस्थापित कर सकती हैं और दो धातुएँ जो ऐसा नहीं कर सकतीं।
उत्तर:
सोडियम और कैल्शियम तनु अम्लों से हाइड्रोजन को विस्थापित कर सकते हैं कॉपर और सिल्वर तनु अम्लों से हाइड्रोजन को विस्थापित नहीं कर सकते।
प्रश्न 8.
धातु M के इलेक्ट्रोलाइटिक शोधन में एनोड, कैथोड और इलेक्ट्रोलाइट का नाम बताइए।
उत्तर:
एनोड: अशुद्ध धातु की
छड़ कैथोड: शुद्ध धातु
इलेक्ट्रोलाइट की छड़: धातु एम के घुलनशील नमक का जलीय घोल।
प्रश्न 9.
प्रत्यूष ने सल्फर पाउडर को एक चम्मच पर लेकर गरम किया। जैसा कि चित्र में दिखाया गया है, उसने इसके ऊपर एक परखनली को उल्टा करके विकसित गैस को एकत्र किया।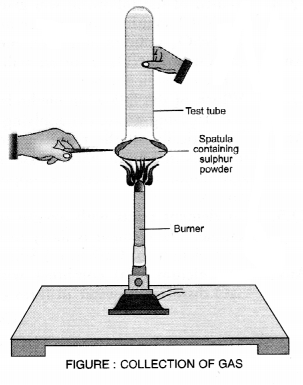
गैस पर क्या क्रिया होगी
- सूखा लिटमस पेपर?
- नम लिटमस पेपर?
होने वाली अभिक्रिया के लिए संतुलित रासायनिक समीकरण लिखिए।
(सीबीएसई 2011)
उत्तर:
सल्फर पाउडर को एक स्पैटुला पर गर्म करने पर निकलने वाली गैस सल्फर डाइऑक्साइड है![]()
- SO2 ( g) में शुष्क लिटमस पेपर की कोई क्रिया नहीं होती है।
- SO2 ( g) नम लिटमस पेपर में मौजूद नमी (पानी) में घुलकर सल्फ्यूरस एसिड बनाता है। अम्लीय विलयन में नम लिटमस पत्र लाल रंग में बदल जाएगा।
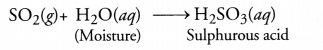
प्रश्न 10.
लोहे को जंग लगने से बचाने के दो उपाय बताइए।
जवाब:
- लोहे की सतह पर ग्रीस या पेंट का लेप लगाकर।
- लोहे की सतह पर जिंक की परत जमा करके। प्रक्रिया को गैल्वनीकरण कहा जाता है।
प्रश्न 11.
अधातुओं के ऑक्सीजन से संयोग करने पर किस प्रकार के ऑक्साइड बनते हैं ?
उत्तर:
ऑक्साइड आमतौर पर प्रकृति में अम्लीय होते हैं जिसका अर्थ है कि पानी में घुलने पर, उनके घोल नीले लिटमस को लाल में बदल देते हैं। उदाहरण के लिए,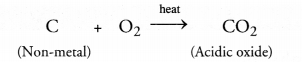
प्रश्न 12.
निम्नलिखित के कारण बताइए :
(क) प्लेटिनम, सोना और चांदी का उपयोग आभूषण बनाने में किया जाता है।
(बी) सोडियम, पोटेशियम और लिथियम तेल के नीचे संग्रहित होते हैं।
(c) एल्युमिनियम एक अत्यधिक प्रतिक्रियाशील धातु है लेकिन फिर भी इसका उपयोग खाना पकाने के बर्तन बनाने के लिए किया जाता है।
(डी) कार्बोनेट और सल्फाइड अयस्क आमतौर पर निष्कर्षण की प्रक्रिया के दौरान ऑक्साइड में परिवर्तित हो जाते हैं। (सीबीएसई 2013, 2014)
उत्तर:
(ए) गतिविधि श्रृंखला के निचले भाग में रखी गई ये धातुएं प्रकृति में बहुत कम प्रतिक्रियाशील होती हैं। सोना और
प्लेटिनम महान धातुओं के रूप में जाने जाते हैं। वे हवा, पानी और रसायनों से प्रभावित नहीं होते हैं। चूंकि इनकी चमक तेज होती है, इसलिए इन धातुओं से आभूषण बनाए जा सकते हैं।
(बी) गतिविधि श्रृंखला में उच्च प्रतिक्रियाशील धातुएं हैं। वायु में ऑक्सीजन, जलवाष्प और कार्बन डाइऑक्साइड की उपस्थिति के कारण वायु में इनकी सतह धूमिल हो जाती है। पानी के साथ, ये इतनी अधिक गर्मी विकसित करने के लिए हिंसक रूप से प्रतिक्रिया करते हैं कि उन्हें संभालना संभव नहीं है। इन धातुओं को आमतौर पर मिट्टी के तेल में रखा जाता है जिसमें हवा और पानी नहीं होता है।
(सी) हवा के संपर्क में आने पर, धातु एल्यूमीनियम ऑक्साइड (अल 2 सीओ 3 ) नामक अपने ऑक्साइड को बदल देती है। यह धातु की सतह पर जमा हो जाता है और सतह पर एक सुरक्षात्मक कोटिंग बनाता है। इस परत की उपस्थिति के कारण, धातु अक्रियाशील हो जाती है और खाना पकाने के बर्तन बनाने में इसका उपयोग किया जा सकता है।
(डी) धातुओं के कार्बोनेट और सल्फाइड दोनों अयस्कों को सीधे धात्विक अवस्था में नहीं बदला जा सकता है। फ्लोवर, धातु ऑक्साइड को कोक या अन्य कम करने वाले एजेंटों के साथ आसानी से कम किया जा सकता है। इसलिए, दोनों को कैल्सीनेशन प्रक्रिया (कार्बोनेट अयस्कों के लिए) और रोस्टिंग प्रक्रिया (सल्फाइड अयस्कों के लिए) द्वारा अपने संबंधित ऑक्साइड में परिवर्तित किया जाता है।
धातु के आक्साइड को कोक (C) या किसी अन्य उपयुक्त अपचायक के साथ आसानी से धात्विक रूप में अपचयित किया जा सकता है। इसलिए, कार्बोनेट और सल्फाइड को कैल्सीनेशन और रोस्टिंग की प्रक्रियाओं द्वारा ऑक्साइड रूप में परिवर्तित किया जाता है और सीधे कम नहीं किया जाता है।
प्रश्न 13.
आपने तांबे के कलंकित बर्तनों को नींबू या इमली के रस से साफ करते देखा होगा। बताएं कि ये खट्टे पदार्थ बर्तनों की सफाई में क्यों कारगर होते हैं। (सीबीएसई 2014)
उत्तर:
कॉपर धातु हवा में मौजूद पानी, कार्बन डाइऑक्साइड और ऑक्सीजन के साथ धीरे-धीरे प्रतिक्रिया करके बेसिक कॉपर कार्बोनेट बनाती है जो हरे रंग का होता है। इसकी परत धातु की सतह पर धीरे-धीरे जमा हो जाती है। अब नींबू
के रस में साइट्रिक एसिड होता है जबकि टैटरिक एसिड मौजूद होता है इमली। ये दोनों एसिड कॉपर एसीटेट (साइट्रिक एसिड के साथ) और कॉपर टार्टारेट (टारटरिक एसिड के साथ) जैसे घुलनशील लवण बनाने के लिए बेसिक कॉपर कार्बोनेट के साथ प्रतिक्रिया करते हैं। प्रतिक्रियाओं के लिए समीकरण जटिल हैं और नहीं दिए गए हैं। ये लवण तांबे की धातु की सतह से हटा दिए जाते हैं और धातु की सतह चमक जाती है।
प्रश्न 14.
एक आदमी घर-घर जाकर सुनार बनकर आया। उन्होंने सुस्त सोने के गहनों पर चमक वापस लाने का वादा किया। एक अनजान महिला ने उसे सोने की चूड़ियों का एक सेट दिया जिसे उसने एक विशेष घोल में डुबोया। चूड़ियाँ नए की तरह चमक उठीं लेकिन उनका वजन काफी कम हो गया था। महिला परेशान हो गई और एक व्यर्थ तर्क के बाद, आदमी ने जल्दबाजी में पीछे हटना शुरू कर दिया। क्या आप नपुंसक द्वारा उपयोग किए गए समाधान की प्रकृति की भविष्यवाणी कर सकते हैं?
उत्तर:
आदमी ने वास्तव में एक्वा रेजिया (शंकु का मिश्रण। एचसीएल और शंकु का मिश्रण। एचएनओ 3 मात्रा के अनुपात में 3: 1 के अनुपात में) का उपयोग किया था, जिसने घुलनशील ऑरिक क्लोराइड (एयूसीएल 3 ) बनाने वाले सोने को भंग कर दिया है।) चूंकि सोने ने वास्तव में प्रतिक्रिया दी थी, सोने की चूड़ियों के वजन में कमी आई थी। सतह से सोने की सुस्त परत को हटाने से चूड़ियों पर असली चमक आ गई। रासायनिक प्रतिक्रियाएं हुई हैं
प्रश्न 15.
कारण बताइए कि तांबे का उपयोग गर्म पानी की टंकियां बनाने के लिए क्यों किया जाता है न कि स्टील (लोहे की मिश्र धातु) के लिए।
उत्तर:
कॉपर स्टील की तुलना में ऊष्मा का बेहतर संवाहक है जो लोहे की मिश्र धातु है। हालांकि तांबा स्टील की तुलना में महंगा है, इसका उपयोग गर्म पानी के भंडारण के लिए स्टील के बजाय गर्म पानी के टैंक बनाने के लिए किया जाता है।
प्रश्न 16.
रासायनिक गुणों के आधार पर धातुओं और अधातुओं में अंतर कीजिए।
रासायनिक विशेषताओं में अंतर के लिए,
संपत्ति | धातुओं | गैर धातु |
1. ऑक्साइड की प्रकृति | धातुओं के ऑक्साइड सामान्यतः क्षारीय प्रकृति के होते हैं (अपवाद: ZnO और Al 2 O 3 उभयधर्मी ऑक्साइड हैं)। | अधातुओं के ऑक्साइड अधिकतर अम्लीय प्रकृति के होते हैं (अपवाद: CO तथा N2O उदासीन ऑक्साइड हैं)। |
2. विद्युत रासायनिक व्यवहार | धातुएं आमतौर पर इलेक्ट्रॉनों के नुकसान से धनायन बनाती हैं। इसका मतलब है कि ये प्रकृति में इलेक्ट्रोपोसिटिव हैं। | गैर-धातुएं आमतौर पर इलेक्ट्रॉनों के लाभ से आयन बनाती हैं। इसका मतलब है कि ये प्रकृति में इलेक्ट्रोनगेटिव हैं। |
| 3. तनु अम्लों के साथ क्रिया | सक्रिय धातुएँ तनु HCl और तनु H2SO4 से अभिक्रिया करके हाइड्रोजन बनाती हैं । | अधातु तनु अम्लों के साथ अभिक्रिया नहीं करते हैं |
| 4. यौगिकों की प्रकृति | धातुओं के यौगिक अधिकतर आयनिक प्रकृति के होते हैं। | अधातुओं के यौगिक अधिकतर सहसंयोजी होते हैं, हालांकि इसके कई अपवाद भी हैं। |
| 5. ऑक्सीकरण और प्रकृति को कम करना | धातुएं अपचायक के रूप में कार्य करती हैं क्योंकि उनके परमाणु इलेक्ट्रॉन खो देते हैं। उदाहरण के लिए, ना —— > ना + + ई – | अधातुएँ ऑक्सीकारक के रूप में कार्य करती हैं क्योंकि उनके परमाणु इलेक्ट्रॉन ग्रहण करते हैं। उदाहरण के लिए, Cl + e – ——–>Cl – |